Катализатор в химии играет решающую роль в ускорении или улучшении химических реакций. Этот важный компонент позволяет снизить энергию активации реакции, что приводит к ускорению скорости процесса. В чем же заключается магия катализаторов и каким образом они влияют на химические превращения?
На молекулярном уровне катализатор представляет собой вещество, которое способно взаимодействовать с реагентами и облегчить прохождение реакции. Сам катализатор при этом остается неизменным и может использоваться вновь и вновь, участвуя во множестве циклических процессов.
Катализаторы подразделяются на гетерогенные и гомогенные в зависимости от того, находятся ли они в том же агрегатном состоянии, что и реагенты. С их помощью можно не только ускорять реакции, но и контролировать химические процессы, обеспечивая большую эффективность и экономичность производства.
Роль катализаторов в химических реакциях

Катализаторы могут быть использованы повторно, так как они не расходуются в процессе реакции. Они могут улучшать эффективность и селективность процесса, обеспечивая получение нужного продукта.
Благодаря применению катализаторов можно снизить температуру и давление, при которых происходит реакция, что обеспечивает более экономичное и безопасное производство химических соединений.
Основные принципы действия катализаторов

Катализаторы ускоряют химические реакции, не участвуя в них напрямую. Они снижают активационное энергетическое барьер и повышают скорость протекания процессов.
Принцип действия катализаторов основан на способности изменять механизм реакций, образуя промежуточные комплексы с более высокой реакционной активностью.
Виды катализаторов в химии

В химии существует несколько типов катализаторов, каждый из которых играет свою уникальную роль в ускорении химических реакций. Среди них выделяют:
1. Гомогенные катализаторы, которые находятся в одной фазе с реагентами и продуктами реакции.
2. Гетерогенные катализаторы, которые находятся в другой фазе относительно реагентов и продуктов.
3. Ферменты, которые являются биологическими катализаторами и активно участвуют в метаболических процессах организмов.
4. Индукционные катализаторы, которые активируются в процессе реакции и способны повысить скорость химического превращения.
Каждый из этих видов катализаторов имеет свои особенности и применяется в различных областях химии для ускорения и оптимизации химических процессов.
Механизм действия ферментов как катализаторов
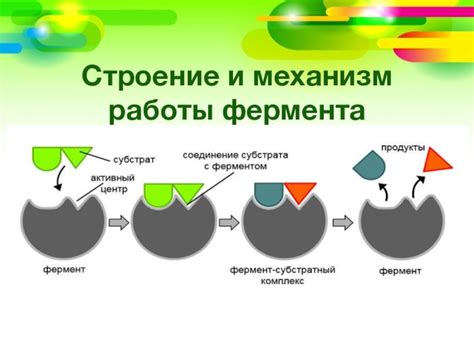
Механизм действия ферментов основан на их способности связываться с молекулами реагента и образовании комплекса фермент-субстрат. Это приводит к изменению конформации фермента, активации катализируемой реакции и образованию конечного продукта.
Ферменты сами при этом остаются неизмененными, поэтому могут использоваться многократно. Кроме того, они действуют очень специфически, выбирая определенные субстраты для катализа реакции. Это обеспечивает точность и эффективность биохимических процессов в клетке.
Примеры промышленного использования катализаторов

1. Производство аммиака: Применение железо-молибденового катализатора в процессе синтеза аммиака позволяет значительно увеличить производительность и снизить энергозатраты.
2. Конверсия тяжелых углеводородов: Катализаторы на основе платины или палладия используются для конверсии тяжелых углеводородов в бензин и дизельное топливо.
3. Производство полимеров: Процессы полимеризации и катализа полимеров в промышленном масштабе необходимы для производства пластмасс и синтетических материалов.
| Реакция | Катализатор | Процесс |
|---|---|---|
| Гидрирование | Никель | Превращение двойной связи в одинарную, например, в процессе производства маргарина |
| Окисление | Ванадий | Производство кислорода и лабораторных реакций |
Влияние температуры на эффективность катализаторов
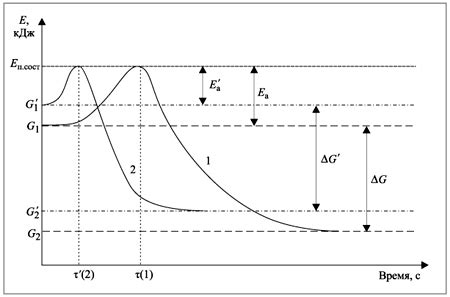
Температура играет важную роль в работе катализаторов. Повышение температуры обычно приводит к увеличению скорости химической реакции, включая процессы, с участием катализаторов. Однако, с увеличением температуры, катализаторы могут деградировать и потерять свою активность.
На низких температурах активность многих катализаторов может быть недостаточной для достижения значимой скорости реакции. В таких случаях повышение температуры может увеличить количество активных центров на поверхности катализатора и увеличить скорость реакции.
С другой стороны, некоторые катализаторы могут быть термически нестабильными и при повышении температуры начинают разрушаться, что приводит к потере активности. Поэтому оптимальная температура работы катализатора зависит от его химической природы и свойств.
Исследования в области катализаторов позволяют оптимизировать температурные условия работы и повысить эффективность химических процессов, в которых они применяются.
Возможные негативные последствия использования катализаторов

Хотя катализаторы играют важную роль в химических реакциях, их использование также может иметь негативные последствия:
| 1. Загрязнение окружающей среды: | Kатализаторы могут стать источником загрязнения окружающей среды, особенно если они содержат токсичные или опасные вещества. |
| 2. Потенциальная опасность для здоровья: | Некоторые катализаторы могут быть вредными для здоровья, особенно если люди работают с ними без соответствующей защиты и предосторожности. |
| 3. Накопление отходов: | Использование катализаторов может привести к накоплению отходов, которые могут быть трудно утилизировать или переработать. |
| 4. Уменьшение эффективности катализатора: | Повторное использование катализатора может привести к его деградации и уменьшению эффективности реакции. |
Основные свойства эффективного катализатора
Эффективный катализатор обладает следующими основными свойствами:
- Активность: способность ускорять химическую реакцию без самостоятельного участия в ней.
- Специфичность: способность катализатора действовать только на конкретную реакцию или группу реакций.
- Стабильность: способность сохранять свои каталитические свойства в течение длительного времени.
- Регенерируемость: возможность восстановления катализатора после его использования.
Инновации в области катализаторов в современной химии

Одной из важнейших тенденций является создание нанокатализаторов, которые имеют нанометровые размеры и обладают улучшенной активностью и селективностью в реакциях. Благодаря использованию нанотехнологий удалось значительно повысить эффективность катализаторов и снизить расход реактивов.
Важным направлением исследований является также разработка биокатализаторов, основанных на ферментах или живых клетках. Эти инновационные катализаторы позволяют проводить реакции при мягких условиях и получать ценные продукты с минимальным воздействием на окружающую среду.
Создание гетерогенных катализаторов с высокой поверхностной активностью и стабильностью также является одним из ключевых достижений современной химии. Эти катализаторы эффективно применяются в промышленности для синтеза важных химических продуктов.
Роль катализаторов в устойчивом развитии промышленности

| Аспект | Роль катализаторов |
|---|---|
| Энергоэффективность | Катализаторы позволяют снизить энергозатраты на процессы, что способствует экономии ресурсов и снижению выбросов в атмосферу. |
| Селективность | Благодаря катализаторам возможно контролировать процессы и обеспечивать получение нужного продукта с минимальным количеством отходов. |
| Экологичность | Применение катализаторов способствует уменьшению вредных выбросов и снижению экологической нагрузки от производственных процессов. |
Таким образом, катализаторы не только улучшают процессы промышленности, но и важны для обеспечения устойчивого развития отраслей с учетом экологических и энергетических аспектов.
Вопрос-ответ

Что такое катализатор в химии?
Катализатор – это вещество, которое ускоряет химическую реакцию, не изменяя при этом своего состава. Он облегчает процесс перехода реакционных веществ в продукты реакции.
Как работает катализатор в химической реакции?
Катализатор вступает во взаимодействие с реагентами и облегчает прохождение реакции за счет создания новых путей преобразования, обеспечивая снижение активационной энергии.
Какие функции выполняет катализатор в химических процессах?
Катализаторы в химии могут выполнять различные функции: ускорять реакцию, улучшать выбор продуктов, снижать температуру и давление, увеличивать эффективность процесса.
Каковы типы катализаторов в химии?
В химии существуют различные типы катализаторов: гомогенные и гетерогенные, однофазные и многофазные, биологические и фотохимические катализаторы.
Почему использование катализаторов важно для химических процессов?
Использование катализаторов в химии позволяет существенно улучшить экономические показатели производства, повысить скорость реакции, снизить затраты на энергию и сырье, а также сократить образование побочных продуктов и отходов.



