В мире химических реакций существуют впечатляющие соединения, которые поражают своей сложностью и значимостью. Одним из таких необыкновенных дуэтов, который заслуживает особого внимания, является соединение соли и воды. Они представляют собой самобытные элементы природы, способные образовывать уникальные химические соединения и процессы.
При первом взгляде может показаться, что соль и вода – слишком обыденные и привычные вещества. Но за этой простотой скрывается множество интересных особенностей, связанных с их взаимодействием. Будучи субстанциями, имеющими разную физическую природу, соль и вода создают иной облик при совместном сосуществовании. Это проявляется в их способности вступать в реакции, образуя новые вещества с совершенно другими физико-химическими свойствами.
Особенностью этого сочетания состоит в том, что соль и вода могут взаимно сильно влиять друг на друга. Благодаря химическим реакциям, возникающим при контакте этих компонентов, происходит изменение их структуры и свойств. Присутствие соли может оказывать воздействие на физические свойства воды, а вода, в свою очередь, может влиять на способность соли растворяться. В результате такого взаимодействия образуется устойчивое соединение, которое обладает уникальными химическими свойствами.
Химический состав и свойства соли и воды
Соль, также известная как минеральный компонент, является химическим соединением, присутствующим в природе и используемым в различных отраслях нашей жизни. Это продукт химической реакции, образующийся при взаимодействии кислоты и основания. Соли могут обладать разнообразными свойствами в зависимости от их состава и структуры.
Вода, жидкость, обладающая уникальными свойствами, является основным источником жизни на нашей планете. Она представляет собой химическое соединение двух атомов водорода и одного атома кислорода. Вода имеет высокую плотность, теплоемкость и показатели вязкости, что делает ее идеальным растворителем для многих веществ.
| Состав | Свойства |
|---|---|
| Соль |
|
| Вода |
|
Состав и свойства соли и воды уникальны и имеют важное значение в химии и других науках. Изучение их химических реакций и взаимодействия с другими веществами позволяет нам понять их роль в природе и применить их в различных областях нашей жизни.
Процесс диссоциации соли в воде
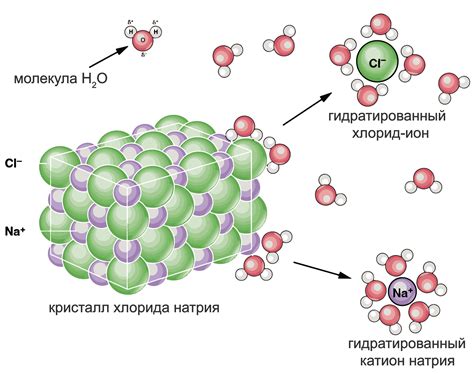
Раздел "Процесс диссоциации соли в воде" затрагивает важный аспект взаимодействия соли и воды, именно тот, который связан с разложением соли на ионы при контакте с водой. Отдельные частицы соли распадаются на положительно и отрицательно заряженные ионы, что приводит к изменениям в физических и химических свойствах раствора.
При взаимодействии соли с водой, наблюдается явление диссоциации – разделение частиц соли на ионы разных зарядов. Положительные ионы соли называются катионами, а отрицательные – анионами. Диссоциация соли в воде происходит благодаря водородным связям.
Процесс диссоциации имеет значительное влияние на электролитические свойства раствора. Полученный раствор становится электролитом, т.е. способным проводить электрический ток, поскольку в нем находятся движущиеся заряженные частицы.
Диссоциация является обратимым процессом - ионы могут снова образовывать частицы соли при определенных условиях. Это свойство диссоциированных растворов солей может быть использовано в различных химических реакциях и промышленных процессах.
Образование ионов при растворении соли

В данном разделе будет рассмотрено процесс образования ионов при взаимодействии солей с водой. Этот процесс подразумевает разделение молекул соли на положительно и отрицательно заряженные части, называемые ионами.
В результате растворения соли в воде, положительные ионы соли, такие как катионы, и отрицательные ионы соли, анции, образуются изначально нейтральными молекулами. При этом происходит рассеивание водных молекул вокруг ионов соли, образуя так называемую гидратную оболочку.
Образование ионов при растворении соли сопровождается электролитическими реакциями, где ионы соли переходят из твердого состояния в раствор. Эти реакции представляют собой обмен ионами или диссоциацию молекул соли.
Полученные ионы имеют заряды, которые соответствуют зарядам катионов и анионов в соли. Эти ионы могут взаимодействовать с другими растворенными веществами или принимать участие в химических реакциях, обладая определенными химическими свойствами.
| Растворенная соль | Положительный ион | Отрицательный ион |
| Хлорид натрия (NaCl) | Натрий (Na+) | Хлор (Cl-) |
| Сульфат магния (MgSO4) | Магний (Mg2+) | Сульфат (SO42-) |
| Нитрат аммония (NH4NO3) | Аммоний (NH4+) | Нитрат (NO3-) |
Влияние температуры на растворимость минеральных веществ в жидкости
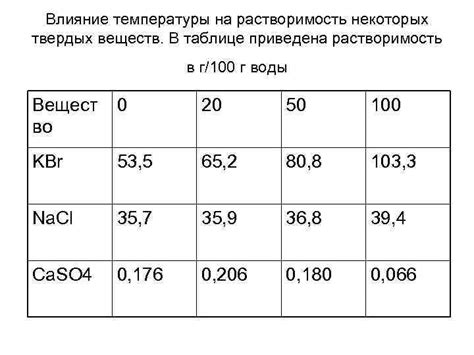
Рассмотрим влияние изменения температуры на способность минеральных веществ растворяться в жидкости. Этот физический процесс находит широкое применение в химической промышленности и повседневной жизни.
Эффект температуры
Благодаря изменению температуры, мы можем увидеть, как растворимость минеральных веществ, таких как соль, изменяется. Оказывается, что в некоторых случаях повышение температуры способствует увеличению растворимости, а в других - уменьшению. Это связано с химическими свойствами веществ и их взаимодействием с молекулами растворителя.
Эндотермические и экзотермические процессы
Изменение растворимости при изменении температуры может быть объяснено через концепцию эндотермических и экзотермических процессов. Эндотермические процессы требуют поглощения тепла, и поэтому при повышении температуры они становятся более выгодными с энергетической точки зрения, что приводит к увеличению растворимости. В то же время, экзотермические процессы выделяют тепло, и поэтому при повышении температуры они становятся менее выгодными, что приводит к уменьшению растворимости.
Примеры
Некоторые минеральные вещества, например, сульфат калия, проявляют эффект повышения растворимости при повышении температуры. Вода становится более способной растворять этот соль, что может быть использовано при его получении в чистом виде. С другой стороны, сульфид железа демонстрирует эффект снижения растворимости при повышении температуры. Это может быть использовано для извлечения этого вещества из растворителя.
Изменение температуры оказывает важное влияние на растворимость минеральных веществ в жидкости. Этот эффект можно объяснить через эндотермические и экзотермические процессы. Знание об этом влиянии позволяет использовать его в различных областях, включая химическую промышленность и научные исследования.
Процессы образования кристаллов из растворов

Образование кристаллов из водных растворов
Как известно, соль является одним из наиболее распространенных веществ в природе. Кристаллизация соли из водных растворов является сложным и интересным процессом, который происходит под влиянием различных факторов, таких как температура, концентрация раствора, наличие примесей и т.д. Распределение ионов соли в растворе и их последующее соединение вокруг центров кристаллизации приводит к образованию структуры кристалла.
Формирование кристаллов является результатом перемещения ионов соли в растворе, их взаимодействия и последующей организации в определенные геометрические формы. Это сложный процесс, подчиняющийся определенным законам и способен порождать разнообразные кристаллические структуры, которые могут отличаться по форме, размеру и свойствам.
Влияние условий на образование кристаллов
Различные факторы, такие как температура, концентрация раствора и наличие примесей, могут оказывать влияние на процесс образования кристаллов. Изменение этих условий может приводить к возникновению кристаллов различной формы и размера, а также к изменению их физических и химических свойств. Кроме того, вещества, присутствующие в растворах соли, могут влиять на скорость кристаллизации и структуру образующихся кристаллов.
В итоге, изучение процессов образования кристаллов из водных растворов позволяет не только понять механизмы образования и свойства кристаллических структур, но и имеет практическую значимость в различных областях науки и промышленности.
Участие соли и воды в жизненно важных процессах

В организме существует постоянное взаимодействие соли и воды, которое является неотъемлемой частью многих биологических процессов. Соли участвуют в регуляции давления, поддержании электрического потенциала мембран, участвуют в конструировании костей и зубов, а также играют важную роль в работе нервной и мышечной систем.
- Соль участвует в поддержании гидроэлектролитного баланса организма, обеспечивая правильное функционирование клеток и тканей.
- Вода играет ключевую роль в биологических процессах, таких как транспорт питательных веществ и кислорода, выведение отходов метаболизма, регуляция температуры тела и обеспечение межклеточного обмена веществ.
- Соль и вода совместно обеспечивают правильное функционирование клеток и органов организма.
- Они участвуют в регуляции объема и осмотического давления клеток, что необходимо для их нормального функционирования.
- Соль и вода также играют роль в обмене веществ, транспортируя питательные вещества и гормоны по организму.
- Они участвуют в регуляции кислотно-щелочного баланса организма, воздействуя на pH различных жидкостей в организме.
Таким образом, соль и вода являются неотъемлемыми компонентами многих биологических процессов, обеспечивая правильное функционирование клеток и организма в целом. Их взаимодействие играет ключевую роль в поддержании жизненных функций и гомеостаза организма.
Практическое применение соли и воды в различных отраслях
1. Продовольственная промышленность:
- Соль и вода широко используются в процессе приготовления пищи, обеспечивая ее вкус и текстуру;
- Соль используется для консервации и соления продуктов, сохраняя их свежесть и продолжительность хранения;
- Вода служит основой приготовления различных продуктов и напитков.
2. Промышленный сектор:
- Соль и вода используются в химической промышленности для производства различных химических реагентов и соединений;
- Водные растворы солей применяются для создания электролитов в аккумуляторах и батареях;
- Вода играет ключевую роль в процессах охлаждения и теплообмена в многих промышленных установках;
- Соль используется в металлургической промышленности для обработки металлов и получения сплавов.
3. Сельское хозяйство:
- Соль и вода используются для орошения посевов и поддержания оптимального влажностного режима почвы;
- Вода служит основным ресурсом для животноводства и орошения сельскохозяйственных культур;
- Соль является важным элементом питания животных и используется в кормах.
Это лишь некоторые примеры практического применения соли и воды. В различных отраслях и сферах деятельности эти ресурсы находят широкое применение, демонстрируя свою важность и необходимость для обеспечения различных процессов и жизнедеятельности.
Вопрос-ответ

Какая химическая реакция происходит между солью и водой?
Химическая реакция между солью и водой называется гидратацией. В результате этой реакции ионы соли разделяются на положительные и отрицательные и соприкасаются с водными молекулами, образуя гидраты. Таким образом, соль диссоциирует в воде.
Что происходит, когда мы растворяем соль в воде?
При растворении соли в воде происходит диссоциация, то есть исходные молекулы соли разделяются на положительные и отрицательные ионы. Водные молекулы окружают ионы и образуют гидраты. Таким образом, соль полностью растворяется в воде.
Какой эффект наблюдается при растворении соли в воде?
При растворении соли в воде наблюдается эффект понижения температуры. Это явление называется эндотермической реакцией. Когда молекулы соли проникают в воду, они забирают тепло у окружающей среды, что приводит к снижению температуры раствора.
Почему соль растворяется в воде, а не в других растворителях?
Соль растворяется в воде благодаря специальным взаимодействиям между ионами соли и водными молекулами. Вода является полярным растворителем, то есть у нее есть положительный и отрицательный полюс. Эти полярные свойства воды позволяют ей эффективно взаимодействовать с ионами соли и образовывать гидраты.
Как соль влияет на свойства воды?
Соль влияет на свойства воды, особенно на ее плотность и точку замерзания. Когда соль растворяется в воде, плотность раствора становится выше, чем у чистой воды. Это объясняется наличием ионов соли в растворе, которые занимают пространство и увеличивают его плотность. Кроме того, соль снижает точку замерзания воды, делая ее менее склонной к замерзанию.



