Температура является одним из основных факторов, влияющих на скорость протекания химических реакций. Изучение этого вопроса имеет ключевое значение для понимания собственно самих процессов в химии.
Рост температуры обычно приводит к увеличению скорости химической реакции. Это связано с тем, что при повышении температуры частицы веществ начинают двигаться быстрее, что увеличивает их энергию. Увеличение энергии позволяет частицам преодолевать энергетический барьер и ускоряет химическую реакцию.
Однако есть и исключения. Некоторые химические реакции могут замедлиться при слишком высоких температурах из-за изменения условий среды, в которой происходит реакция, или из-за распада и перекристаллизации продуктов.
Влияние температуры на скорость
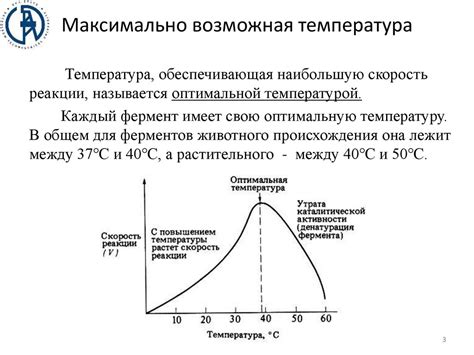
Температура играет важную роль в химических реакциях. По общему правилу, с увеличением температуры скорость химической реакции увеличивается. Это связано с тем, что при повышении температуры происходит увеличение скорости молекулярного движения.
Ускорение реакции: При повышении температуры энергия частиц увеличивается, что приводит к более сильным и чаще встречающимся столкновениям молекул. Таким образом, активация реакции происходит быстрее и скорость реакции увеличивается.
Плавающее равновесие: Однако, необходимо помнить, что изменение температуры может оказывать влияние на равновесие реакции. Например, при повышении температуры реакции, некоторые реакции могут сдвигать равновесие в сторону обратимой реакции.
Влияние температуры на скорость химических реакций
Температурные изменения реакций

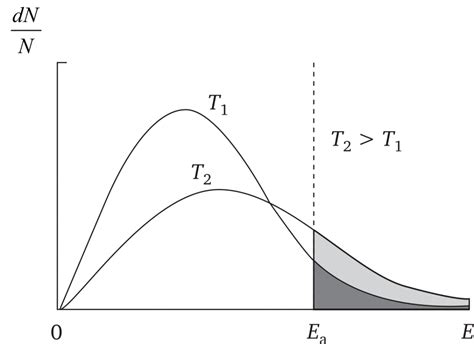
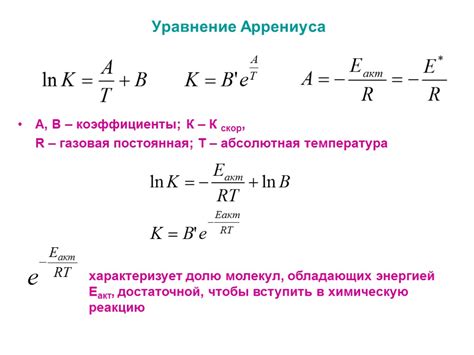
Температура играет ключевую роль в химических реакциях, поскольку она влияет на скорость реакции. По общему правилу, увеличение температуры приводит к увеличению скорости реакции. Это происходит благодаря увеличению энергии частиц, что приводит к увеличению вероятности успешного столкновения молекул. Этот эффект иллюстрирует закон Аррениуса, который утверждает, что скорость реакции удваивается для каждого увеличения температуры на 10 градусов Цельсия.
Однако, слишком высокие температуры могут также привести к разрушению молекул или изменению химической структуры, что может остановить реакцию или изменить продукты. Поэтому важно контролировать и поддерживать оптимальную температуру для конкретной химической реакции, чтобы добиться желаемых результатов.
Их скорости
Скорость химических реакций напрямую зависит от температуры. По закону Вант-Гоффа, увеличение температуры приводит к увеличению скорости реакции. Это объясняется тем, что с повышением температуры частицы вещества приобретают большую энергию, что способствует более сильному столкновению молекул и, следовательно, увеличению скорости химической реакции.
Таким образом, при повышенных температурах реакции протекают быстрее, что может быть использовано для ускорения процессов синтеза и прочих процессов, связанных с химией.
Важность температуры для реакций
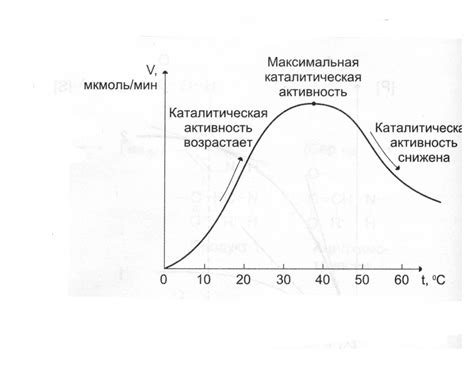
Температура играет ключевую роль в химических реакциях, влияя на их скорость и характер. Повышение температуры часто приводит к увеличению скорости реакции, поскольку это увеличивает среднюю энергию молекул и стимулирует частицы к столкновениям. Это может привести к увеличению числа успешных столкновений и, как следствие, к ускорению процесса реакции.
При этом, в некоторых случаях увеличение температуры может изменить характер реакции или привести к обратимому процессу. Например, при высоких температурах некоторые реакции могут идти по альтернативному механизму или привести к образованию различных продуктов, чем при низких температурах.
| Положительное воздействие температуры | Отрицательное воздействие температуры |
|---|---|
| Увеличение скорости реакции | Изменение равновесия реакции |
| Стимулирование частиц к столкновениям | Возможность альтернативных механизмов |
| Увеличение числа успешных столкновений | Образование различных продуктов |
Их эффективности
Однако, в некоторых случаях слишком высокая температура может стать препятствием для реакции, так как может вызвать разложение реагирующих веществ или изменение механизма реакции. Поэтому важно находить оптимальные условия температуры для каждой конкретной реакции, чтобы обеспечить максимальную эффективность процесса.
Таким образом, контроль температуры играет важную роль в химических реакциях и может значительно повлиять на их эффективность и скорость.
Энергия активации реакций
И тепловое воздействие

Температура имеет прямое влияние на скорость химических реакций: возрастание температуры обычно ускоряет реакции, а ее понижение, наоборот, замедляет их ход. Это объясняется тем, что тепловое движение частиц увеличивается при повышении температуры, что способствует столкновениям частиц и инициирует процессы химических реакций. Важно отметить, что температура также влияет на энергию активации реакции, при повышении температуры энергия активации уменьшается, что ускоряет процесс формирования продуктов.
Вопрос-ответ

Почему при повышении температуры скорость химической реакции увеличивается?
При повышении температуры молекулы системы начинают двигаться быстрее и с большей энергией, что приводит к увеличению вероятности их столкновений и, как следствие, увеличению скорости реакции. Также при повышении температуры происходит увеличение эффективного столкновения частиц, что ускоряет процессы перехода реагентов в продукты и увеличивает скорость реакции.
Может ли слишком высокая температура негативно повлиять на скорость химической реакции?
Да, слишком высокая температура может негативно повлиять на скорость химической реакции. При очень высоких температурах возможно разрушение молекул или изменение структуры реагентов, что может привести к нежелательным побочным реакциям. Кроме того, при слишком высокой температуре законченность и чистота реакции могут быть нарушены. Поэтому важно подбирать оптимальную температуру для каждой конкретной реакции.