Механизм образования сульфата кальция при взаимодействии гидроксида кальция с серной кислотой
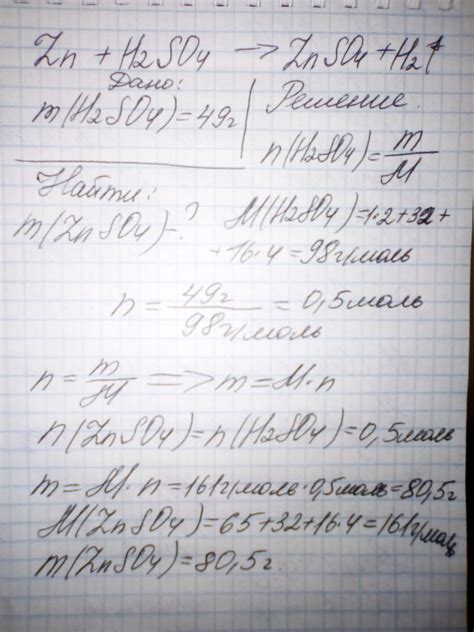
В данном разделе представлено объяснение механизма образования сульфата кальция в результате взаимодействия гидроксида кальция с серной кислотой. Рассмотрены этапы химической реакции и влияние условий среды на процесс образования сульфата кальция.
- Диссоциация серной кислоты: при добавлении серной кислоты в воду происходит ее диссоциация на ионы водорода (H+) и сульфатные ионы (SO4^2-). Данная реакция осуществляется в присутствии воды, которая действует в качестве растворителя.
- Реакция гидроксида кальция с ионами водорода: гидроксид кальция, присутствующий в растворе, реагирует с ионами водорода из серной кислоты, образуя воду и ионы кальция (Ca^2+).
- Окисление ионов кальция: ионы кальция, полученные в результате реакции с гидроксидом кальция, подвергаются окислению под воздействием кислорода из воздуха. Образование окиси кальция (CaO) приводит к реакции с сульфатными ионами, образуя сульфат кальция (CaSO4).
- Образование сульфата кальция: в результате окисления ионов кальция и реакции с сульфатными ионами образуется твердый кристаллический осадок сульфата кальция. Осадок можно извлечь путем фильтрации реакционной смеси.
Таким образом, взаимодействие гидроксида кальция с серной кислотой приводит к образованию сульфата кальция, который является веществом с широким спектром применения в различных отраслях науки и промышленности.
Структура и свойства гидроксида кальция

В данном разделе будут рассмотрены структура и основные свойства гидроксида кальция, вещества, известного также как незаменимый компонент в различных отраслях промышленности и науки.
- Кристаллическая структура: гидроксид кальция образует кристаллическую решетку, состоящую из ионов кальция (Ca2+) и ионов гидроксида (OH-). Эти ионы находятся взаимодействии за счет электростатических сил притяжения, формируя прочные химические связи.
- Физические свойства: гидроксид кальция представляет собой белый кристаллический порошок низкой плотности. При нагревании он образует воду и оксид кальция (известный как негашеная известь), что свидетельствует о его способности к дегидратации.
- Щелочные свойства: гидроксид кальция обладает щелочным характером и способен образовывать гидроксидные ионы (OH-) в водном растворе. Это позволяет ему реагировать со многими кислотами, в том числе с серной кислотой.
- Поглощение влаги: гидроксид кальция является гигроскопическим веществом, то есть способным поглощать влагу из окружающей среды. Это свойство делает его незаменимым в различных процессах, таких как сушка газов и жидкостей.
- Медицинское применение: благодаря своему антацидному действию и способности нейтрализовать избыток соляной кислоты, гидроксид кальция используется в медицине для лечения пищеварительных расстройств, таких как изжога и кислотный рефлюкс.
Исходя из указанных структурных и свойственных характеристик гидроксида кальция, можно лучше понять его взаимодействие с различными веществами, в том числе с серной кислотой, которое будет рассмотрено в следующих разделах.
Структура и свойства серной кислоты
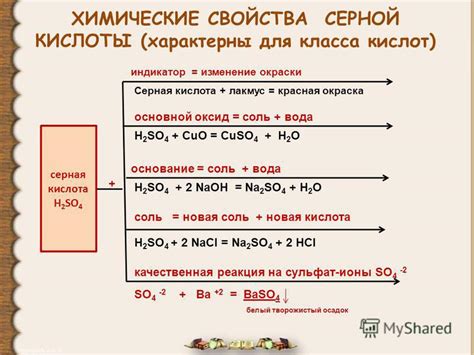
Серная кислота представляет собой бесцветную, очень коррозионную жидкость, имеющую характерный запах и обладающую сильными кислотными свойствами. Она широко применяется в промышленности, лаборатории и в различных химических процессах. Структура и свойства серной кислоты определяют ее химическую активность и эффективное взаимодействие с другими соединениями.
Молекула серной кислоты состоит из двух атомов водорода, атома серы и четырех атомов кислорода, связанных между собой в подобие кольца. В такой структуре серная кислота проявляет высокую кислотность, обусловленную наличием нескольких гидроксильных групп. Эти группы обладают способностью отдавать протоны, что обеспечивает кислотные свойства серной кислоты.
Одной из важных характеристик серной кислоты является ее высокая растворимость в воде. Это объясняется образованием водородных связей между молекулами воды и молекулами серной кислоты. Благодаря этому, серная кислота образует гигроскопичные растворы, которые могут быстро взаимодействовать с различными веществами и вызывать реакции, изменяющие их свойства.
Примечание: данная статья фокусируется на обсуждении структуры и основных свойств серной кислоты, с целью предоставить читателю полное представление о данном соединении.
Химическая реакция между оксидом кальция и сульфатной кислотой
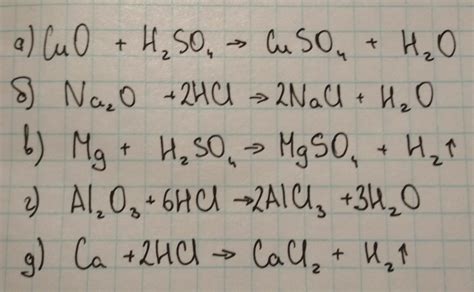
В данном разделе рассмотрим химическую реакцию, которая происходит между оксидом кальция и сульфатной кислотой. Эта реакция основана на взаимодействии ионов кальция и ионов сульфата, что приводит к образованию новых веществ.
Опишем последовательность этой реакции. Сначала ионы сульфатной кислоты реагируют с молекулами оксида кальция, образуя сульфат кальция и воду. Сульфат кальция, в свою очередь, является нерастворимым соединением и образует осадок.
Реакция между оксидом кальция и сульфатной кислотой может быть представлена уравнением:
- CaO + H₂SO₄ -> CaSO₄ + H₂O
Эта реакция является экзотермической, то есть сопровождается выделением тепла. К тому же, образование нерастворимого соединения (сульфата кальция) приводит к образованию осадка.
Результатом этой реакции является образование сульфата кальция и воды. Сульфат кальция может использоваться в различных отраслях промышленности, а также в медицине и сельском хозяйстве. В результате реакции также наблюдается изменение свойств исходных веществ.
Кинетика реакции вещества с серной кислотой
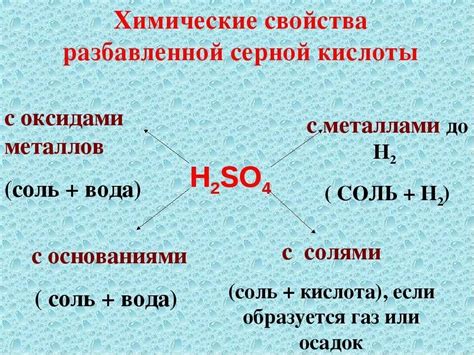
В данном разделе рассматривается временная зависимость хода химической реакции между указанными веществами. Данная информация позволяет оценить скорость протекания реакции и определить факторы, влияющие на ее скорость.
Изучение кинетики реакции гидроксида кальция с серной кислотой позволяет установить соотношение между скоростью реакции и концентрацией исходных веществ, а также выявить возможные механизмы протекания реакции.
Методы исследования кинетики включают измерение изменения концентрации реагентов и продуктов реакции со временем. Полученные данные позволяют построить графики изменения концентрации, а также описать математическую модель, описывающую зависимость скорости реакции от концентраций реагентов.
На основе экспериментальных результатов построены кинетические уравнения для данной реакции, учитывающие влияние различных факторов на скорость реакции. Из этих уравнений можно определить влияние температуры, концентрации исходных веществ, а также наличия катализаторов на скорость протекания реакции.
Изучение кинетики реакции гидроксида кальция с серной кислотой имеет практическое значение, так как позволяет оптимизировать условия реакции в промышленных процессах. Также это важно для понимания химических процессов, протекающих в природных системах.
Влияние концентрации реагентов на скорость реакции

Изменение концентрации реагентов может оказать значительное влияние на скорость химической реакции. Более высокая концентрация одного или обоих реагентов может привести к более быстрой реакции, поскольку повышение концентрации увеличивает количество столкновений между молекулами реагентов.
С другой стороны, снижение концентрации реагентов может замедлить реакцию, так как уменьшается количество столкновений между молекулами. Это означает, что меньше эффективных столкновений между молекулами реагентов, способных привести к образованию новых химических связей.
Кроме того, изменение концентрации реагентов может привести к изменению равновесия реакции. Высокая концентрация одного реагента может сдвинуть равновесие в сторону продуктов, тогда как низкая концентрация может сдвинуть равновесие в сторону реагентов.
Исследование влияния концентрации реагентов на скорость реакции позволяет лучше понять кинетические свойства химических процессов и оптимизировать условия реакции для достижения желаемых результатов.
Роль температуры в процессе взаимодействия
Температура вещества, вступающего в химическую реакцию, определяет амплитуду колебаний молекул и их активность. При повышении температуры, молекулы обладают большей кинетической энергией, что способствует частым и энергичным столкновениям. Таким образом, тепло влияет на скорость реакции, ускоряя ее ход.
В контексте взаимодействия гидроксида кальция с серной кислотой, повышение температуры приводит к увеличению скорости образования серного гидроксида и растворения кальция. В результате, тепловая энергия, выделяющаяся в процессе реакции, увеличивает температуру системы, что может сказываться на окружающей среде.
| Температура (°C) | Влияние на реакцию |
|---|---|
| Низкая | Реакция протекает медленно, количество образующегося серного гидроксида и растворенного кальция ограничено. Выделяемое тепло незначительно. |
| Средняя | Реакция протекает средней скоростью, большее количество серного гидроксида и растворенного кальция образуется. Выделяемое тепло средней интенсивности. |
| Высокая | Реакция протекает быстро, образуется большое количество серного гидроксида и растворенного кальция. Выделяемое тепло интенсивно. |
Таким образом, температура играет важную роль в процессе взаимодействия гидроксида кальция с серной кислотой, определяя скорость и результат реакции. Дальнейшее изучение этого фактора может привести к оптимизации условий и повышению эффективности этой химической реакции.
Роль ионных обменников в каталитическом влиянии на реакцию

Данная секция статьи рассматривает ключевую роль ионных обменников в процессе каталитического влияния на реакцию между гидроксидом кальция и серной кислотой. Мы изучаем механизмы ионного обмена, а также влияние данных обменников на скорость и результаты реакции.
Роль ионных обменников
Ионные обменники представляют собой материалы, способные обращать одни ионы в другие в растворе. В контексте данной реакции, ионные обменники выполняют важную каталитическую функцию, активно взаимодействуя с ионами кальция и серной кислоты. Они способны прискорбно обменять ионы кальция на ионы, которые играют важную роль в энергетическом процессе реакции, обеспечивая ее быстроту и эффективность.
Механизм влияния ионных обменников
Механизм влияния ионных обменников на реакцию между гидроксидом кальция и серной кислотой основан на их способности активно обменивать ионы, что позволяет ускорить скорость самой реакции. Кроме того, ионные обменники обладают поверхностью с высокой площадью, что способствует увеличению активного контакта с реагентами и повышению вероятности их взаимодействия. В результате, каталитическое влияние ионных обменников способствует ускорению и более полному осуществлению реакции мeжду гидроксидом кальция и серной кислотой.
Результаты влияния ионных обменников
Результаты влияния ионных обменников на реакцию связаны с увеличением скорости и эффективности протекания процесса. Благодаря активному обмену ионами, ионные обменники способствуют более плотному связыванию молекул гидроксида кальция и серной кислоты, ускоряя образование гидратных слоев и специфических комплексов. Это приводит к более быстрому достижению равновесия и обеспечивает формирование стабильных продуктов реакции.
Определение стехиометрии взаимодействия основного оксида и кислоты: результаты и анализ

В данном разделе представлен анализ стехиометрии взаимодействия основного оксида и кислоты на примере гидроксида кальция и серной кислоты. Изучение данного процесса позволяет более глубоко понять химическую реакцию, происходящую между данными веществами, а также определить соотношение между ними.
Для определения стехиометрии данной реакции проведено титрование полученного осадка с использованием щавелевой кислоты, которая является известным окислителем. В процессе титрования происходит точное определение молярного соотношения между основным оксидом и кислотой. Полученные данные записываются и обрабатываются с использованием математических методов.
- Благодаря проведенному титрованию установлена точная молярная соотношение гидроксида кальция и серной кислоты: 1 моль гидроксида кальция соответствует 1 моль серной кислоты.
- Данная информация важна для дальнейших исследований и применений данных веществ в различных областях, например, в процессах очистки воды, производстве удобрений и других химических процессах.
Таким образом, определение стехиометрии взаимодействия гидроксида кальция с серной кислотой позволяет установить точное соотношение между этими веществами и имеет важное значение для понимания и применения данных химических реакций.
Титрование растворов средствами химии: исследование взаимодействия гидроксидных и кислотных соединений

В данной статье будет исследован процесс титрования растворов гидроксида кальция с использованием серной кислоты. Титрование позволяет определить точное соотношение между исследуемыми соединениями и выявить их химические свойства.
В процессе титрования будет измеряться объем серной кислоты, добавляемой к раствору гидроксида кальция, и регистрироваться изменение pH-уровня смеси. Это позволит определить точку эквивалентности титрования, когда в исследуемой системе присутствуют одинаковые количества реагентов.
Полученные данные будут анализироваться для определения концентрации гидроксида кальция в исходном растворе. Также будет изучен эффект растворимости гидроксида кальция в зависимости от его концентрации и pH-уровня окружающей среды.
Вопрос-ответ

Каким образом происходит взаимодействие гидроксида кальция с серной кислотой?
При взаимодействии гидроксида кальция (Ca(OH)2) с серной кислотой (H2SO4) происходит процесс нейтрализации. Молекулы гидроксида кальция отдают свои ионы OH-, которые реагируют с ионами водорода H+ из серной кислоты. В результате этой реакции образуются молекулы воды (H2O) и сульфат кальция (CaSO4).
Какие результаты можно получить при взаимодействии гидроксида кальция с серной кислотой?
Результатом взаимодействия гидроксида кальция с серной кислотой является образование сульфата кальция, который представляет собой белый кристаллический порошок. Также в результате реакции образуется молекула воды. Реакция происходит с выделением тепла.
Какие особенности механизма взаимодействия гидроксида кальция с серной кислотой?
Механизм взаимодействия гидроксида кальция с серной кислотой основан на процессе нейтрализации. Ионы OH- из гидроксида кальция реагируют с ионами H+ из серной кислоты, образуя молекулы воды и сульфат кальция. Эта реакция является экзотермической и происходит с выделением тепла.
Какова роль гидроксида кальция и серной кислоты в данной реакции?
Гидроксид кальция играет роль основания, так как его молекулы отдают ионы OH-, которые вступают в реакцию с ионами H+ из серной кислоты. Серная кислота, в свою очередь, является кислотой и отдает свои ионы водорода для реакции нейтрализации. Таким образом, оба вещества взаимодействуют для образования сульфата кальция и воды.



